Charles Yasası: Gazların Sıcaklık ve Hacim İlişkisi
Charles Yasası, gazların sıcaklık ve hacim ilişkisini açıklayan temel bir fizik yasasıdır. Fransız bilim insanı Jacques Charles tarafından 18. yüzyılda keşfedilen bu yasa, ideal gazların davranışını anlamada önemli bir rol oynar. Charles Yasası, basınç sabit tutulduğunda, bir gazın hacminin sıcaklıkla doğru orantılı olduğunu belirtir. Bu, sıcaklık arttıkça gazın hacminin de arttığı, sıcaklık azaldıkça hacminin küçüldüğü anlamına gelir.
Matematiksel olarak, Charles Yasası şu şekilde ifade edilir:
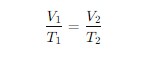
Bu formülde:
- V1V_1 ve V2V_2 gazın başlangıç ve son hacimlerini,
- T1T_1 ve T2T_2 gazın başlangıç ve son mutlak sıcaklıklarını (Kelvin cinsinden) ifade eder.
Örneğin, sıcak hava balonları Charles Yasası’nın pratik bir uygulamasıdır. Balonun içindeki hava ısıtıldığında, sıcaklık artışı gazın hacminin genişlemesine neden olur ve balon yükselir. Bu, havanın hacminin sıcaklıkla nasıl değiştiğinin günlük hayattaki gözle görülür bir örneğidir.
Charles Yasası’nın geçerli olabilmesi için, gazın basıncının sabit kalması gerekir. Bu yasa, günlük hayatta birçok uygulama alanına sahiptir. Örneğin, motorlu araçlarda içten yanmalı motorların çalışması, yakıt ve hava karışımının ısıtılmasıyla hacminin genişlemesine dayanır. Aynı şekilde, kriyojenik gazların depolanması ve taşınması sırasında da Charles Yasası’ndan yararlanılır.
Sonuç olarak, Charles Yasası, gazların sıcaklık ve hacim arasındaki ilişkiyi anlamamızı sağlar. Bu yasa, sadece teorik bir kavram olmanın ötesinde, pratik uygulamalarıyla da teknolojik gelişmelere katkıda bulunur. Gazların davranışlarını anlamak, mühendislikten bilimsel araştırmalara kadar pek çok alanda önemli avantajlar sunar.








